Cristallo (dal greco: cristallos, propriamente, ghiaccio). Corpo allo stato solido che si sviluppa in forma poliedrica (cioè delimitata da facce piane che si intersecano secondo spigoli e vertici) legata a particolari caratteristiche dell’edificio cristallino. Un cristallo idealmente perfetto è costituito da un reticolo tridimensionale regolare, formato da una successione di "celle elementari" contenenti ciascuna un’identica distribuzione di atomi o ioni. Si chiamano cristalline le sostanze che allo stato solido assumono spontaneamente forma geometrica regolare; le altre sostanze sono dette amorfe. Lo stato cristallino deve essere considerato oltre che quello "abituale", quello "normale" dei solidi. Caratteristica essenziale dello stato cristallino è la disposizione reticolare ordinata, secondo un omogeneo periodico, discontinuo, degli atomi costituenti la sostanza. Tale disposizione si ripete invariata nelle tre dimensioni e ammette quindi che, traslando di un certo periodo secondo tre possibili vettori non complanari, ogni atomo ritrovi il suo uguale in identica posizione. Nei gas, nei liquidi, nei solidi non cristallini abbiamo invece che, o le molecole, o gli atomi, o gli ioni presenti hanno disposizione disordinata e (per i soli fluidi) continuamente mutevole. Possiamo quindi contrapporre al disordine dei fluidi e dei solidi non cristallini l’ordine delle fasi cristalline.La differenza sostanziale tra i solidi cristallini e i fluidi e i solidi non cristallini dall’altra, si concretizza ulteriormente se prendiamo in considerazione il concetto di omogeneità.
Omogeneità: Si definisce omogenea una sostanza dal punto di vista chimico-fisico, quando due o più porzioni di questa sostanza, presentano identiche proprietà chimico-fisiche e non sono quindi differenziabili tra loro.
Anisotropia: Proprietà per cui certi fenomeni chimico-fisici (dilatazione termica, conducibilità termica, elettrica e luminosa, induzione elettrica e magnetica, velocità d’attacco da parte di un reattivo chimico, da cui derivano le figure di corrosione) assumono valori diversi nelle diverse direzioni considerate.
Anisotropia discontinua caratteristica dei solidi cristallini per cui certe proprietà variano in modo irregolare da una direzione all’altra, la manifestazione più evidente di tale fenomeno è la forma poliedrica dei cristalli (facce e spigoli).
Alcune fra le più importanti proprietà fisiche verificabili nella materia allo stato cristallino si esplicano con modalità del tutto particolari e in conseguenza di ciò richiedono per la loro conoscenza nozioni, metodi e strumenti del tutto particolari. Alcune proprietà fisiche, non sono riportabili a grandezze esprimibili con numeri, come ad esempio molti effetti di colore, malleabilità, la duttilità ecc. Queste proprietà possono soltanto essere descritte con valutazioni grossolanamente quantitative. Sono usualmente chiamate caratteri di una data sostanza: ad esempio, sono caratteri dello Zolfo il colore giallo citrino e la forte fragilità. Alcune proprietà invece, scegliendo opportunamente la definizione, sono riportabili a grandezze misurabili. Ad alcune di queste grandezze non è associabile il concetto di direzione; così il peso specifico, il calore specifico, il punto di fusione ecc. In questo caso la grandezza è scalare e la proprietà stessa potrà essere detta scalare. Ad altre grandezze è invece associabile il concetto di direzione (indice di rifrazione, velocità di accrescimento ecc.) e le proprietà descritte da grandezze di questo tipo potranno essere dette direzionali o vettoriali. Le proprietà direzionali possono dirsi continue quando, col variare della direzione, il vettore rappresentativo della loro grandezza varia il proprio modulo con continuità, cioè senza forti scarti da una direzione a un’altra immediatamente vicina. Il mezzo sarà detto isotropo per quella data proprietà; sarà detto anisotropo invece, se il modulo del vettore rappresentativo della grandezza della proprietà sarà diverso in varie direzioni. Ad esempio il Salgemma è otticamente isotropo, poiché tutte le proprietà ottiche sono identiche nelle varie direzioni; è anisotropo per l’elasticità, poiché il modulo di elasticità in varie direzioni è diverso. Le proprietà direzionali potranno essere discontinue quando, per piccole variazioni della direzione, il vettore che ne rappresenta la grandezza salta bruscamente a valori molto diversi. Così ad esempio la coesione nel Salgemma é una proprietà direzionale discontinua che assume bruscamente un valore minimo secondo tre piani ortogonali tra loro (piani di sfaldatura), da cui la sfaldatura di tipo cubico del Salgemma
Ricordiamo fra le più importanti proprietà fisiche dei cristalli:
1) Il peso specifico determinato o col picnometro o con la bilancia di Westphal per solidi; 2) La Piezoelettricità. Questo fenomeno, è ad esempio caratteristico nel Quarzo; una lamina di Quarzo a facce piane e parallele, tagliata perpendicolarmente a un asse binario, sviluppa cariche di segno opposto sulle due facce, se sottoposta a compressione. Mantenendo sempre compressa la lamina toccando le due facce con una bacchetta metallica, si elimineranno le cariche elettriche. Decomprimendo la lamina si formeranno nuovamente cariche elettriche, di segno contrario a quelle formatesi in precedenza. 3) La Piroelettricità. Alcuni cristalli hanno la particolarità di elettrizzarsi polarmente quando vengono sottoposti a variazioni di temperatura.
Pertanto
l’insorgenza di proprietà fisiche anisotrope nello stato solido
cristallino, richiede per la verifica dell’omogeneità fisica di due o
più porzioni, prese in considerazione nel corpo oggetto di studio, che
vengano esaminate mantenendo inalterate le loro reciproche relazioni di
orientazione. Inoltre tale concetto di omogeneità è valevole
soltanto entro determinati limiti di grandezza. La materia allo stato cristallino è sempre e spontaneamente anisotropa, almeno per alcune proprietà. Altre proprietà possono invece in un cristallo non essere variabili con la direzione: la specie cristallina sarà detta isotropa per tali proprietà. Anisotropie
sono riscontrabili anche in solidi non cristallini, ma esse non sono
insorte spontaneamente, ma sono state acquisite secondariamente in
conseguenza di azioni meccaniche (tensioni interne provocate dalla
contrazione per raffreddamento, effetti di laminazione, di stiramento
ecc.). Un altro gruppo di sostanze sono dette a struttura fibrosa, sono anch’esse sostanze organiche, come la cellulosa, le proteine, il caucciù e i polimeri artificiali a catena lunga.
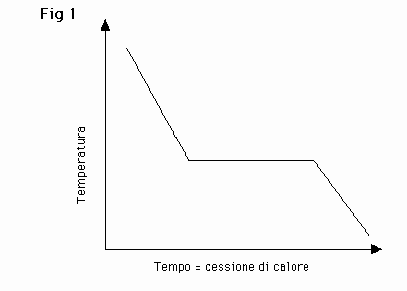
Se forniamo calore a un solido cristallino a P=K, questo subisce un incremento continuo della temperatura ƒ=(cal specifico del corpo), continuando a somministrare calore si raggiungerà una temperatura fissa e specifica per ogni sostanza cristallina, alla quale la trepidazione atomica, espressione del contenuto di energia interna, soverchia i legami reticolari che presiedono alla stabilità dell’edificio cristallino. Questo si oblitera lasciando liberi, in fase disordinata (amorfa), atomi, ioni, molecole. Questa trasformazione dal cristallino all’amorfo coincide generalmente col passaggio dallo stato solido a quello liquido; pertanto essendo la trasformazione solido-liquido facilmente constatabile e di facile determinazione, per molte sostanze cristalline il punto di fusione è un dato diagnostico importante per il riconoscimento della sostanza stessa o del suo grado di purezza. Nel passaggio inverso liquido-solido si osserva analogamente un punto di solidificazione, che, salvo l’insorgere di soprafusione, coincide con il punto di fusione e segnala la transizione dallo stato amorfo al cristallino. Lasciando raffreddare un fuso in ambiente a temperatura inferiore al suo punto di solidificazione, il liquido cede calore e la sua temperatura decresce con continuità e con velocità ƒ=(cal specifico del liquido). Giunti al punto di solidificazione si inizia la cristallizzazione, il sistema continua a cedere calore all’ambiente, senza che ciò porti però a un abbassamento di temperatura, fino a quando tutto il liquido sia cristalizzato (solidificato). Completata la solidificazione la temperatura riprende ad abbassarsi proporzionalmente al calore ceduto.
Nel passaggio solido-liquido il comportamento termico del sistema è analogo. Somministrando calore al solido, giunti al punto di fusione, l’innalzamento di temperatura si arresta ed il calore somministrato è speso e assorbito nel passaggio dalla fase ordinata del cristallo a quella disordinata del liquido. Alla temperatura di fusione le due fasi possono coesistere, ma evidentemente il contenuto di energia interna della fase liquida disordinata è maggiore. Questo comportamento specifico dei solidi cristallini che passano a temperatura fissa, invariante a pressione costante, allo stato amorfo liquido, non avviene nelle sostanze vetrose che rappresentano il più tipico esempio di solido non cristallino. Lo stato vetroso non è identificabile con lo stato solido "normale". Definiremo pertanto cristallina la materia allo stato solido, che presenti proprietà vettoriali esplicantesi secondo direzioni conseguenti alla geometria dell’omogeneo periodico
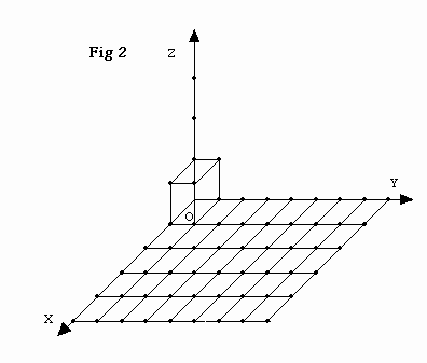
L'omogeneo periodico discontinuo tridimensionale ammette in tre direzioni non complanari, quell’operazione di simmetria che si chiama traslazione secondo una terna di vettori non complanari. Spostando il sistema geometrico, secondo una traslazione, definita in direzione, in verso e in lunghezza (periodo), ogni punto dello spazio ricopre se stesso, cioé si trova a coincidere con un punto perfettamente uguale a quello di partenza, sia per la qualità di materia ivi esistente (o assente), sia per la disposizione degli altri punti che lo circondano.
Caratteristica della struttura dei cristalli è la ripetizione periodica, a intervalli regolari e nelle tre direzioni dello spazio, di alcuni elementi strutturali. Proprio questa caratteristica consente di semplificare la descrizione dei cristalli attraverso operazioni di simmetria sia semplici che composte. Oltre la già citata operazione di simmetria semplice: traslazione che definisce il periodo di ripetizione , altre operazioni di simmetria semplice di 1a specie come la rotazione (che definisce gli assi di simmetria attorno ai quali, immaginati passanti per il centro del reticolo, il reticolo ruotando può ricoprire se stesso un numero n volte nel giro di 360°.), e di 2a specie come l’inversione (che si verifica quando nel sistema geometrico ogni punto trova il suo identico sulla retta che lo unisce al centro di figura, alla stessa distanza dal centro, ma dalla parte opposta di questo centro di simmetria.), e la riflessione (che definisce i piani di simmetria e si verifica quando il sistema geometrico può essere diviso da un piano in due parti specularmente uguali), nonchè, operazioni di simmetria composta come le elicogire, derivanti dalla somma di operazioni di simmetria semplice di 1a specie: traslazione+rotazione, gli slittopiani, derivanti dalla somma di operazioni di simmetria semplice di 2a specie: traslazione+riflessione, la rotoriflessione, derivante dalla somma di operazioni di simmetria semplice di 2a specie: rotazione+riflessione e la rotoinversione, derivante anch’essa dalla somma di operazioni di simmetria semplice di 2a specie: rotazione+inversione, consentono di completare la descrizione della struttura cristallina, anche se complessa.
I possibili modi di ricoprimento differenziabili tra di loro danno origine a quattordici reticoli di traslazione elementari di Bravais: (reticolo triclino; reticolo monoclino; reticolo monoclino a basi centrate; reticolo rombico semplice; reticolo rombico a basi centrate; reticolo rombico corpo centrato; reticolo rombico con tutte le facce centrate; reticolo tetragonale semplice; reticolo tetragonale corpo centrato; reticolo romboedrico; reticolo esagonale a base centrata; reticolo cubico semplice; reticolo cubico a corpo centrato; reticolo cubico a facce centrate). E’ quindi possibile suddividere i cristalli in classi di simmetria, riunendo in una stessa classe tutti i cristalli che, pur avendo composizione chimica ≠, hanno uno stesso grado di simmetria, cioè una medesima combinazione di elementi di simmetria. Ciò porta alla definizione di sette sistemi cristallini riuniti in tre gruppi, e suddivisi in trentadue classi. La classe con il massimo grado di simmetria possibile nel sistema a cui appartiene è detta classe oloedrica.
Le considerazioni fin qui fatte valgono ovviamente per cristalli ideali, in cui cioè si suppongono puntiformi gli atomi costituenti. In realtà è più corretto assimilare gli atomi che occupano i vertici dei reticoli a sfere (in quanto hanno un volume definito) e considerare quindi i cristalli come raggruppamenti compatti e regolari di sfere di varie dimensioni.
La
prima ipotesi sulla struttura dei cristalli fu enunciata da René
Just Haüy (1784). Osservando i piani di sfaldatura (ossia piani a
minore coesione meccanica) che presentavano tutti i cristalli di Calcite
, Haüy suppose che le forme molto diverse di questo minerale
derivassero dalla sovrapposizione conveniente e prevedibile di uno
stesso parallelepipedo elementare, da lui detto molecola integrante. Da
ciò dedusse che le sostanze cristallizzate possiedono una struttura
omogenea periodica , un ordine che si oppone al disordine degli altri
stati della materia (dei gas, dei liquidi, dei solidi amorfi), e inoltre
solo tale struttura poteva spiegare l’anisotropia dei cristalli.
Tra le proprietà direzionali che si riscontrano nella materia allo stato cristallino la velocità di accrescimento può manifestarsi vistosamente nel cristallo macroscopico, portando allo sviluppo delle forme poliedriche esterne. I cristalli si formano infatti per crescita graduale dai piccolissimi germi cristallini, invisibili anche ai più forti ingrandimenti microscopici, attraverso una successiva deposizione di materia, che consente loro di raggiungere talvolta dimensioni notevoli (diversi metri, come in certi quarzi). Questo accrescimento si svolge però in modo anisotropo conseguentemente alla natura reticolare del cristallo. Nella grande maggioranza delle sostanze allo stato cristallino, formatesi in natura o prodotte artificialmente dall’uomo, le modalità di cristallizzazione portano a diretto contatto gli innumeri singoli cristalletti, ostacolando o impedendo lo svilupparsi di piani perpendicolari alle direzioni di minimo accrescimento, cioè delle facce cristalline. La materia allo stato cristallino si presenta quindi generalmente sotto forma di aggregati il più delle volte granulari, talvolta fibrosi, aciculari, raggiati, ecc., ma non con habitus poliedrico. La formazione del cristallo limitato da facce richiede ambienti genetici particolari che infrequentemente si verificano in natura e con difficoltà in laboratorio. Recentemente sono state sviluppate tecniche particolari (alcuni di questi esperimenti sono stati condotti in assenza di gravità a bordo dello space shuttle), che permettono di ottenere monocristalli di grandi dimensioni anche per sostanze microgranulari. Già dalla metà del secolo passato il Bravais stabiliva "In un cristallo le facce più importanti sono quelle che nel proprio reticolo segnano piani reticolari più densi" Come facce più importanti si intendono genericamente quelle più sviluppate, quelle coincidenti con piani di sfaldatura, ecc. Sulla base della conoscenza oggi acquisita che l’elemento di ripetizione nelle strutture cristalline è l’atomo e non la "molecola cristallina", come pensava il Bravais, il principio di Bravais può essere più correttamente formulato nel modo seguente: "In un cristallo le facce più importanti sono quelle che nella propria struttura segnano piani a maggiore densità atomica".
La Legge della costanza dell’angolo diedro.
Nella fig 3 è rappresentato un ottaedro regolare, nella fig 4 sono riprodotti cristalli ottaedrici distorti; gli angoli tra le facce sono però sempre quelli caratteristici dell’ottaedro. La distorsione dei cristalli avviene cioé mantenendo le facce parallele a sé stesse, e non infirma quindi la validità della legge della costanza dell’angolo diedro. In altre parole, un cristallo è un ottaedro quando è limitato da otto piani paralleli a due a due e facenti fra di loro due angoli di 109° 28’ 16’’, sia quando questi piani sono equidistanti dal centro, come nei cristalli con habitus ottaedrico regolare, e sia quando non lo sono, come nei cristalli con habitus ottaedrico sproporzionato.
La legge di Haüy o della razionalità degli indici
I tre numeri h, k, l, segnati tra parentesi tonde e senza segni di interpunzione, costituiscono gli indici delle facce secondo Miller, e sono oggi il modo di notazione più comunemente usato. Gli indici milleriani si riferiscono per convenzione il primo all’asse x, che si orienta generalmente con la parte positiva rivolta verso l’osservatore: il secondo all’asse y, con la parte positiva sulla destra dell’osservatore; il terzo all’asse z, verticale con z positivo verso l’alto. Quando l’asse è incontrato dalla parte negativa si antepone il segno meno all’indice relativo. Gli indici di ogni faccia racchiusi in parentesi tonda vengono assunti come simbolo della faccia (h k l). Tutte le facce dello stesso tipo, che costituiscono una forma semplice, hanno simboli derivabili, da quello di una sola faccia, per mezzo di cambiamenti di segno e di permutazioni degli indici riferentesi a direzioni equivalenti, tenuto conto della simmetria del cristallo. Il simbolo di una forma semplice è dato dagli indici di una sua faccia racchiusi tra parentesi graffa {h k l}. Il simbolo di una forma semplice è dato dagli indici di una faccia racchiusi tra parentesi graffa {h k l}. Infine il simbolo di una zona, la quale è costituita da tutte le facce parallele a uno spigolo, detto anche della zona, è dato dagli indici dello spigolo racchiusi tra parentesi quadra [h k l ].
Definizione di minerale
Minerale: qualsiasi corpo solido naturale, costituito da un solo elemento o da un composto chimico, facente parte della nostra Litosfera o di quella di un altro pianeta, che si trovi allo stato solido cristallino; ovvero, sia caratterizzato, da una disposizione reticolare ordinata secondo un omogeneo, periodico, discontinuo e tridimensionali degli atomi costituenti la sostanza. La sua composizione deve esprimersi mediante una formula chimica. I minerali, presentano, generalmente, valori costanti e definiti entro certi limiti di certe proprietà fisiche: (durezza, peso specifico,sfaldatura,...) I solidi cristallini non sempre sono caratterizzati da facce, spigoli e vertici ben sviluppati, pertanto nell’identificazione dei minerali occorre utilizzare altre proprietà quali il colore, la lucentezza, il peso specifico, la durezza, la sfaldatura, la temperatura di fusione, la suscettività magnetica, la fluorescenza, la fosforescenza, la birifrazione ecc.
Diamo ora un rapido sguardo ad alcune di tali proprietà:
Colore. Il colore é utilissimo per la identificazione di un minerale. Il verde della Malachite, il celeste dell’Azzurrite, il giallo dello Zolfo e della Pirite o il viola del Quarzo ametista sono così caratteristici che spesso bastano da soli ad identificarli. Il colore di un minerale dipende principalmente dalla sua costituzione chimica; i minerali colorati contengono di solito Ferro, Cromo, Manganese, Cobalto, Nichel, Titanio, Rame. In alcuni minerali della stessa specie il colore può variare da campione a campione in base alle impurezze presenti, anche in minima quantità (2-3%) e anche per difetti reticolari. Il Quarzo (SiO2) può essere incolore, bianco, rosa, violetto e persino nero. Peso specifico. Se si prendono in mano diversi minerali e si prova a soppesarli ci si rende conto immediatamente che alcuni sono più pesanti di altri. Il peso specifico di un corpo é il rapporto tra il peso del corpo e il peso di un ugual volume di acqua distillata a 4° C. Il peso specifico dell’acqua é 1, cioè un litro d’acqua distillata a 4° C pesa un chilogrammo. Il Salgemma ad esempio, ha peso specifico 2,16, il Quarzo 2,65, l’Oro 19,3. Un volume di Oro pari a quello di un litro di acqua pesa 19,3 Kg. Sfaldatura. E’ la proprietà che hanno certi minerali di rompersi facilmente lungo piani preferenziali di debolezza. Questi piani sono in relazione alla disposizione di piani reticolari in cui sono più deboli i legami chimici che uniscono gli atomi. Certi minerali hanno un solo piano, altri più piani di sfaldatura, altri ancora non hanno per niente sfaldatura perché la loro struttura cristallina é omogenea e non contiene piani di debolezza strutturale. Durezza In mineralogia, per durezza si intende la resistenza di un minerale ad essere scalfito o abraso. La durezza dei minerali viene determinata mediante comparazione con una scala standard, detta scala di Mohs, costituita da 10 minerali indici disposti in ordine crescente di durezza. Il primo termine della scala, il più tenero, che si lascia persino scalfire dall’unghia, é il talco; l’ultimo termine, il minerale più duro che esiste in natura, é il diamante; esso é almeno 1000 volte più duro del corindone.
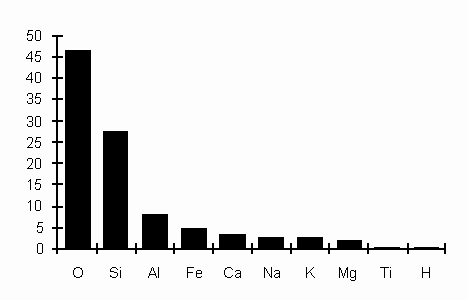
Classificazione dei minerali: I minerali si formano in seguito a vari processi chimici e fisici naturali. I primi tentativi di classificarli risalgono alla fine del XVIII° sec. Nella prima metà del XIX° sec. prevalse la classificazione basata su criteri puramente chimici (J D. Dana, 1837). A partire dal 1944 la classificazione é stata basata su criteri strutturali e chimici (cristallochimici). La più nota classificazione cristallochimica é quella contenuta nelle tabelle mineralogiche di H. Strünz, pubblicate nel 1941 e continuamente aggiornate. In tale classificazione si usa distinguere i minerali in classi, in gruppi, in famiglie, in serie, mentre ciascun minerale, dotato delle stesse proprietà essenziali, composizione chimica e forma cristallina costituisce una specie minerale. Le specie minerali, oggi note, sono oltre duemila (vedi tabella). Le rocce della crosta terrestre sono fondamentalmente costituite da una trentina di minerali (vedi tabella e Diagramma).
I dieci minerali più abbondanti della crosta terrestre
Minerali silicatici più importanti: Quarzo (SiO2) E’ uno dei silicati più comuni e abbondanti ed é costituito da soli tetraedri SiO4 raggruppati in una struttura tridimensionale assai compatta. Microscopicamente: Xenomorfo (M); Xenoblasto (Me); Spigoloso (Se).Incolore al solo polarizzatore, a lucentezza vitrea, con superficie priva di tracce di sfaldature e di principi di alterazione; microfessure a sviluppo irregolare si scorgono all'interno dei cristalli di più grandi dimensioni. Presenta rilievo debole o nullo. nQ>nB Ha bassa birifrangenza con colori di polarizzazione cromatica che arrivano, al max. al bianco del 1° ordine. Alcuni individui presentano un'estinzione anomala (estinzione ondulata) a causa di deformazioni meccaniche. Uniassico positivo. Feldspati. Sono i minerali più abbondanti nelle rocce della crosta terrestre. Vengono distinte due grandi famiglie: i feldspati alcalini e i plagioclasi o feldspati sodico-calcici. Tra i primi ricordiamo: l’ortoclasio, il sanidino il microclino, l’adularia. I plagioclasi sono una miscela in varie proporzioni di due minerali: l’Albite e l’Anortite - (Albite-Oligoclasio-Andesina-Labradorite-Bytownite-Anortite). Microscopicamente: K-Na-Feldspati: incolori al solo polarizzatore; nK< nB; Presentano sfaldature secondo {001} e {010} e {100}. Estinzione inclinata; biassici. Microclino: A nicols + presenta la tipica graticciatura o Kilt (geminazione albite-periclino) a sviluppo polisintetico. Ortoclasio: aspettto torbido della sup. incolore (dovuta ad incipiente o diffusa!alterazione argilloso-sericitica. Bassi colori di polarizzazione cromatica sul bianco-grigio del 1° ordine. A nicols + si evidenziano molto bene le associazioni micropertitiche. segno ottico -. Plagioclasi: habitus tabulare +/- allungati secondo c. Incolori al solo polarizzatore presentano superfici intaccate da principi di alterazione e da tracce di sfaldature. Nei Pl + ricchi in Ca l'alterazione è più diffusa; prodotti polverulenti -> argillificazione prodotti squamosi iridescenti -> Sericitizzazione; nP assente -> debole nei tipi più ricchi in anortite. a nicols + presentano una bassa birifrangenza e colori di polarizzazione cromatica sul bianco-grigio del 1° ordine soltanto l'anortite presenta colori sul giallino del 1° ordine. Presenti sia geminazioni albite che periclino sia primaria che a sviluppo polisintetico. segno ottico sia + che - Feldspatoidi: Leucite: incolore al solo polarizzatore e spesso pecilitica per inclusioni micromineraliche di varia natura; costantemente estinta a nicols + talvolta presenta una birifrangenza anomala. Miche. Trattasi di minerali assai caratteristici che si sfaldano in fogli o scaglie sottilissime. Ciò é possibile grazie alla struttura cristallina costituita da "fogli o strati" successivi di tetraedri SiO4; le miche più importanti sono la muscovite e la biotite. La prima, trasparente, é un silicato idrato di Alluminio e Potassio, la seconda, bruna o nera, é un silicato idrato di Ferro, Magnesio, Alluminio e Potassio. Microscopicamente: Muscovite: incolore al solo polarizzatore con sfaldature secondo (001) che comporta fitti insiemi di striature tra loro parallele sulle sezioni dal contorno rettangolare. Le sezioni basali sono prive di sfaldature; spesso a causa di deformazioni plastiche è dato osservare degli individui piegati o ripiegati (kinks) . Presenta colori di polarizzazione del; 2° ordine, spesso iridescenti; segno ottico - Biotite: presenta habitus rettangolare con bordi sfrangiati, comuni le deformazioni plastiche Ss. Frequenti le inclusioni di minutissimi critalli di zircone attorno ai quali si hanno le tipiche aureole policroiche. L'alterazione è piuttosto diffusa (pseudomorfosi parziali o totali in cloriti, ox- Fe) Marcata sfaldatura basale {001} e intensa colorazione , forte pleocroismo g =b >>a ; oppure b=g ; a= giallognolo g= bruno, bruno scuro,rossiccio b= bruno - a= giallo,giallo-pallido Talora è zeppa di rutilo in minutissime bacchettine a rilievo fortissimo di colore rosso (aggregati sagenitici) segno ottico - Anfiboli e Pirosseni. Sono silicati assai complessi, ricchi di Alluminio, Calcio, Magnesio e Ferro. L’anfibolo più comune é l’orneblenda, di colore verde scuro o nero. Un pirosseno tipico e invece l’Augite, un minerale nero che si trova in molte rocce ignee. A parte la differente disposizione dei tetraedri SiO4, la più importante differenza tra anfiboli e pirosseni sta nel fatto che i primi sono idrati, cioé contengono l’ossidrile (OH). Ciò li rende più leggeri e meno compatti dei pirosseni, i quali a loro volta sono minerali più stabili alle alte temperature e alle alte pressioni. Microscopicamente: Anfiboli: habitus prismatico allungato secondo C, rilievo medio, segno ottico -. I colori di interferenza talvolta vengono mascherati dall'intensa colorazione propria dei cristalli. Le sezioni {010} hanno estinzione inclinata, mentre le sezioni {010} hanno estinzione secondo le diagonali dei prismi di sfaldatura. Diffuse le alterazioni in prodotti cloritico-micacei; comuni sono le strutture di microimplicazione con gli Ox-Fe; raramente omogeneo dal punto di vista ottico sono riscontrabili termini riferibili a orneblende a vario rapporto Fe/Mg (C/g =13°-25°) a= giallo-verdolino pallido; b= verde-verde intenso; g= verde-verde mela- verde azzurro intenso. Pirosseni: habitus prismatico tozzo poco allungato secondo C; presentano sfaldatura prismatica secondo {210} OPx estinzione //; {110} CPx estinzione // Bassa colorazione e pleocroismo poco marcato; NP>NB; max. colori d'interferenza del 1° ordine Frequenti le zonature a "Clessidra" Olivine. L’Olivina é un silicato dal colore verde scuro in cui gli ioni Ossigeno del tetraedro SiO4 non sono in comune con i tetraedri adiacenti. I tetraedri SiO4 sono legati fortemente da ioni di Magnesio e Ferro. L’Olivina, assieme a Pirosseni, Anfiboli e Biotite, costituisce un gruppo di minerali verdastri o nerastri, ricchi di Mg e Fe, che caratterizzano le rocce scure, quasi nere, dette mafiche (Magnesio+Ferro); La Muscovite insieme ai plagioclasi e al Quarzo per contro caratterizza le rocce chiare dette sialiche (Silicio+Alluminio). Microscopicamente: habitus prismatico tozzo o isodiametrico. Incolori al solo polarizzatore o debolmente colorati sul giallo-verdolino; superficie distintamente sagrinata priva di tracce di sfaldatura. Debole pleocroismo; Il rilievo è molto accentuato. segno ottico + facilmente alterabili in Ox e Idrox di Ferro, in serpentino, in clorite.Alterazione serpentinica: nei casi di pseudomorfosi totale si può arrivare ad una struttura a maglie; alterazione iddingsitica l'olivina di colore brunastro per ematite e ghoetite con intenso pleocroismo dal giallo arancione al rosso. Granati: incolori al solo polarizzatore con contorno rotondeggiante e/o scheletriforme, presentano rilievo medio-alto con superficie lesionata da fratture irregolari. alcuni individui presentano tipica struttura cribrosa per inclusioni granulari sparse; poco alterati in prodotti cloritici e/o ematitici; costantemente estinti a nicols +; talvolta presentano una birifrangenza anomala.
Minerali non silicatici più importanti: Circa l’8% della crosta terrestre é costituito da minerali non silicati. I più importanti sono carbonati, solfati e alogenuri, ossidi e idrossidi, solfuri, elementi nativi. Carbonati. Questo gruppo é costituito da due minerali principali, la calcite e la dolomite che formano ripsettivamente le rocce calcaree e dolomitiche. Questi minerali, e le rispettive rocce, si formano principalmente per processi chimici e biochimici nell’acqua del mare. Solfati e Alogenuri. Si tratta di minerali che precipitano per evaporazione di soluzioni concentrate da cui la denominazione collettiva di evaporiti che viene spesso usata. Tra i solfati i minerali più comuni sono il gesso e l’anidrite. Tra gli alogenuri il salgemma, la silvite e la fluorite. trattasi di minerali di considerevole importanza economica. Ossidi e Idrossidi. In questi minerali, un elemento é combinato con l’Ossigeno e, a volte, anche con molecole di H2O. I più comuni sono quelli che contengono Ferro quali magnetite, ematite e limonite. Questi minerali, che spesso tingono di giallo o rosso le rocce in cui si trovano, sono la principale fonte di ferro dell’industria mineraria. Solfuri. Importanti giacimenti minerari sono costituiti da composti metallici dello zolfo. Tra essi ricordiamo la pirite, la calcopirite, la galena, la blenda e il cinabro, dai quali si estraggono rispettivamente rame, piombo, zinco e mercurio. Elementi nativi. Oro, Argento, Rame e in misura minore Carbonio sono i più importanti
La Genesi dei minerali
Ogni fase cristallina può formarsi da una fase gassosa o liquida o solida, ma anche per reazione di più fasi solide, per reazione di un solido con un liquido e così via; la formazione della nuova fase é in genere condizionata da una variazione dell’ambiente chimico-fisico: ad esempio una diminuizione di temperatura, variazione della concentrazione dei componenti del sistema chimico, o del PH, o del potenziale di ossido-riduzione. La formazione dei minerali da una fase gassosa avviene in natura nella genesi pneumatolitica; da una fase liquida nella genesi magmatica, in quella idrotermale e in quella sedimentaria; da una o più fasi solide nella genesi metamorfica. Genesi Pneumatolitica: la formazione di minerali dalla fase gassosa avviene in natura in due condizioni: quando nell’atmosfera si formano cristalli di ghiaccio e quando da gas caldissimi sfuggenti dall’interno della crosta terrestre verso la superficie, e quindi verso minori temperature, minori pressioni e diversi ambienti chimici, si depositano vari tipi di minerali. Genesi Magmatica, Idrotermale, Sedimentaria: la deposizione di fasi solide da un liquido può avvenire in due condizioni molto diverse. Per esempio la formazione di cristalli di NaCl può aversi ad una temperatura vicina al suo punto di fusione (801° C) da un liquido composto o da NaCl puro o mescolato con composti analoghi: (solidificazione) o attraverso l’evaporazione del solvente o per la diminuizione della temperatura. Nella genesi magmatica si ha la cristallizzazione di silicati, ossidi e anche solfuri ad alta temperatura ( da 600 a1200° C circa) da fasi liquide costituite dallo stesso tipo di composti che cristalizzano, più una bassa percentuale di solvente (essenzialmente acqua) che può essere trattenuto solo in presenza di un’adeguata pressione. Questi fusi silicatici sono miscele molto complesse di molti componenti chimici, i più abbondanti dei quali sono i seguenti ossidi: SiO2, Al2O3, Fe2O3, FeO, MgO, CaO, Na2O, K2O uniti alla già menzionata H2O; queste miscele fuse vengono dette magmi. Tra i minerali più comuni che si formano in queste condizioni ricordiamo i felsdspati potassico e sodico-calcico, l’olivina e i pirosseni, gli anfiboli, le miche e il quarzo. Tra i 600 e i 500° C avviene la cosiddetta fase pegmatitica, caratterizzata dalla formazione di cristalli più grandi del normale (per la ridotta viscosità). Mal mano che la temperatura diminuisce e varia l’ambiente chimico (PH, Pot.Redox,...) ci si avvicina alla fase idrotermale; si formano in questa fase il Quarzo, la Pirite, la Fluorite, la Baritina, la Blenda, la Galena, il Cinabro, la Calcite, la Calcopirite, la Calcosina,..). Genesi Sedimentaria: nella genesi sedimentaria si ha la deposizione di fasi cristalline da acque superciali a temperatura ambiente. Attraverso l’"alterazione" di tutti i materiali che si vengono a trovare in un ambiente diverso rispetto a quello in cui si sono formati, gli ioni passano in soluzione e poi convergono in mare dove si esplica tutto il processo sedimentario. Genesi Metamorfica: Tutti i cristalli formatisi in certe condizioni di temperatura, pressione, ambiente chimico, possono venirsi a trovare in nuove condizioni chimico-fisiche. Le fasi preesistenti tenderanno a trasformarsi adeguandosi alle nuove condizioni: (risposta mineralogico-strutturale). Formazione dei cristalli: la formazione dei cristalli avviene in due fasi distinte, nucleazione e accrescimento. La nucleazione può aver luogo solo qualora si abbia un certo grado di sovrasaturazione, e cresce all’aumentare di questa, mentre l’accrescimento avviene anche con valori minimi della sovrasaturazione. Le rocce: salvo rarissime eccezioni, sono aggregati di minerali. Ma, così come con mattoni identici si possono costruire edifici con architetture assai differenziate, allo stesso modo i vari minerali possono essere associati a formare un grandissimo numero di differenti rocce. E se ammettiamo che questo processo di aggregazione non sia un fenomeno casuale, allora il problema sta nel cercare di capire quali sono le leggi naturali che presiedono il tutto. I geologi sono d’accordo nell’ammettere una fondamentale distinzione delle rocce in tre grandi gruppi genetici. Le rocce ignee sono quelle che si formano per raffreddamento di una massa fusa (magma, lava); le rocce sedimentarie, la cui caratteristica principale é di essere stratificate, si possono formare per accumulo di minerali granellini detritici di varia natura, per precipitazione chimica nell’acqua del mare o per l’attività biochimica di organismi; le rocce metamorfiche sono quelle che derivano da rocce precedenti per effetto di calore, pressione e dell’attività chimica associata, in pratica rappresentano una risposta mineralogico-strutturale alle mutate condizioni "geoambientali". L’appartenenza di una data roccia ad uno dei tre gruppi sopradescritti non é immutabile. La crosta terrestre é dinamica ed in continua evoluzione. Rocce sedimentarie o metamorfiche possono venir fuse e produrre rocce ignee e qualsiasi roccia (anche metamorfica) può essere trasformata in una nuova roccia metamorfica. (ciclo delle rocce o litogenetico).
(sull'argomento vedi anche Cenni sui magmi)
|

 Bravais
trovò che in questo modo erano possibili quattordici reticoli spaziali
i quali però spiegavano solo le sette classi oloedriche dei sistemi di
simmetria. Tenendo conto anche della disposizione degli atomi e degli
ioni nei nodi è invece possibile ottenere 230 gruppi spaziali
con nuovi elementi di simmetria: questi ultimi furono introdotti da Sohncke,
Fédorov, Schnflies e Barlow alla fine del XIX° sec. (assi
elicogiri, slittopiani, rotoriflessione, rotoinversione).
Bravais
trovò che in questo modo erano possibili quattordici reticoli spaziali
i quali però spiegavano solo le sette classi oloedriche dei sistemi di
simmetria. Tenendo conto anche della disposizione degli atomi e degli
ioni nei nodi è invece possibile ottenere 230 gruppi spaziali
con nuovi elementi di simmetria: questi ultimi furono introdotti da Sohncke,
Fédorov, Schnflies e Barlow alla fine del XIX° sec. (assi
elicogiri, slittopiani, rotoriflessione, rotoinversione). 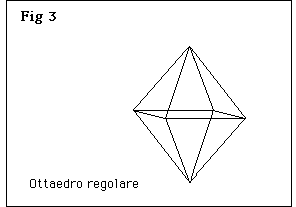 Tale
legge (enunciata da Romé de l’Isle nel 1783, ma già osservata
nel quarzo da Stenone nel 1669 e intuita da Bringuccio nel
1535) dice che: gli angoli diedri che formano tra di loro le facce
dei cristalli di una medesima sostanza sono costanti. La velocità
di accrescimento che,per facce equivalenti, dovrebbe essere teoricamente
uguale, è grandemente influenzata dalle condizioni ambientali della
sede di sviluppo del cristallo, dove fattori dinamici ed equilibri
chimico-fisici particolarmente labili presiedono alla formazione della
fase solida cristallina. Noi così riscontriamo nei cristalli differenze
anche notevoli tra facce equivalenti, che risultano alcune più espanse
altre meno, o, talvolta, addirittura mancanti. I cristalli sono quindi
generalmente distorti. La distorsione in qualche specie cristallina
sarà meno accentuata, mentre talvolta è notevole.
Tale
legge (enunciata da Romé de l’Isle nel 1783, ma già osservata
nel quarzo da Stenone nel 1669 e intuita da Bringuccio nel
1535) dice che: gli angoli diedri che formano tra di loro le facce
dei cristalli di una medesima sostanza sono costanti. La velocità
di accrescimento che,per facce equivalenti, dovrebbe essere teoricamente
uguale, è grandemente influenzata dalle condizioni ambientali della
sede di sviluppo del cristallo, dove fattori dinamici ed equilibri
chimico-fisici particolarmente labili presiedono alla formazione della
fase solida cristallina. Noi così riscontriamo nei cristalli differenze
anche notevoli tra facce equivalenti, che risultano alcune più espanse
altre meno, o, talvolta, addirittura mancanti. I cristalli sono quindi
generalmente distorti. La distorsione in qualche specie cristallina
sarà meno accentuata, mentre talvolta è notevole.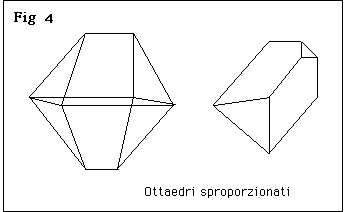
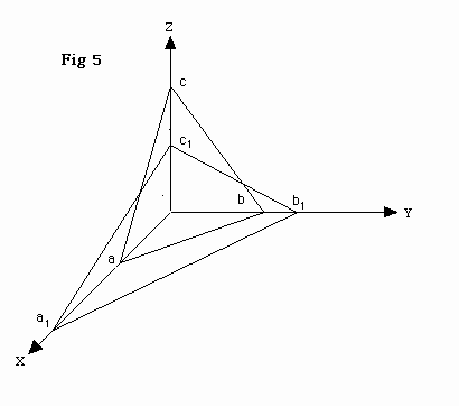 Scelti
tre assi di riferimento (assi cristallografici) paralleli a tre spigoli
esistenti o possibili nel cristallo e scelta una faccia che tagli i tre
assi (faccia fondamentale) secondo segmenti in rapporto a:b:c (rapporto
parametrico fondamentale), ogni altra faccia taglierà sugli assi
segmenti secondo un rapporto a1:b1:c1 tale che a/a1:b/b1:c/c1=h:k:l, con
h, k, l numeri interi e piccoli
Scelti
tre assi di riferimento (assi cristallografici) paralleli a tre spigoli
esistenti o possibili nel cristallo e scelta una faccia che tagli i tre
assi (faccia fondamentale) secondo segmenti in rapporto a:b:c (rapporto
parametrico fondamentale), ogni altra faccia taglierà sugli assi
segmenti secondo un rapporto a1:b1:c1 tale che a/a1:b/b1:c/c1=h:k:l, con
h, k, l numeri interi e piccoli